(c) 2021, The Washington Post - Laurie McGinley, Carolyn Y. Johnson, Yasmeen Abutaleb
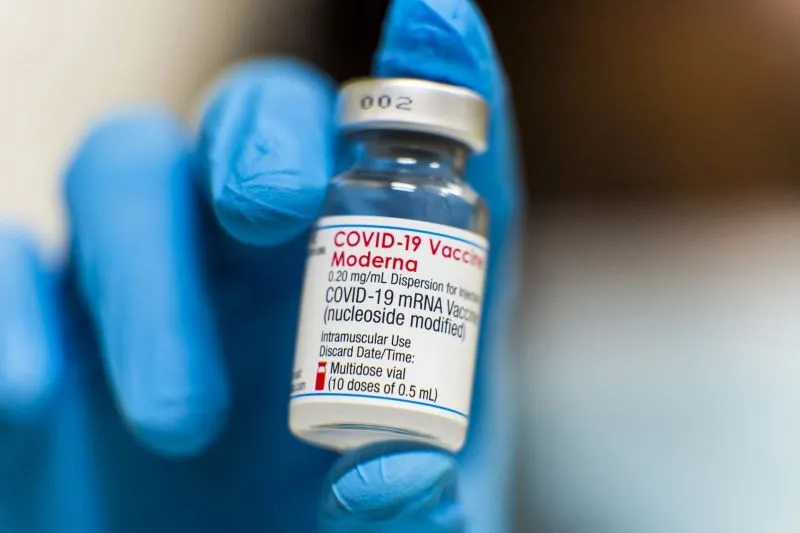
Las autoridades federales han solicitado que las compañías fabricantes de vacunas expandan sus pruebas de las inyecciones contra el coronavirus a varios miles de niños en edad escolar antes de buscar su aprobación – una decisión que busca determinar si una rara inflamación del músculo del corazón que ha sido observada en adultos jóvenes poco después de la vacunación es más común en grupos con edades menores.
Los cambios a las actuales pruebas pediátricas llevadas a cabo por Moderna y Pfizer y su socio alemán, BioNTech, pueden retrasar la disponibilidad de las vacunas para niños entre 5 y 11 años hasta después de la fecha estimada de comienzos de otoño, aunque aún no está claro cuan largo será el retraso. Mientras el país sufre un aumento de contagios principalmente por casos de personas que no han sido vacunadas y el año escolar se aproxima, pediatras y familias han esperado impacientemente por vacunas que puedan proteger a los menores.
Durante el programa televisivo “CNN Town Hall” la semana pasada, el presidente Joe Biden erróneamente dijo que los niños menores de 12 años quizá puedan tener acceso a la vacuna tan pronto como agosto, una fecha que no ha sido proyectada por ninguna de las compañías que trabajan en desarrollar una vacuna pediátrica.
Un funcionario federal que habló en condición de anonimato predijo que una autorización para una vacuna contra el coronavirus para niños de 5 a 11 años quizá pueda lograrse hacia finales de octubre o comienzos de noviembre. El gobierno no siente que será un problema enlistar a más niños para las pruebas ya que son muchos los padres que están deseosos de vacunar a sus hijos, dijo el oficial.
Ray Jordan, vocero de Moderna, dijo que la empresa estaba “activamente discutiendo una propuesta” con las autoridades federales para expandir sus pruebas, pero aún no habían acordado un número exacto. Él predijo que una autorización podría ocurrir para “el invierno de 2021 o comienzos del año 2022”.
“El objetivo es armar una base de datos de seguridad más grande, lo cual incrementa la probabilidad de detectar eventos no comunes”, dijo Jordan en un email. Las pruebas originales incluían casi 7.000 niños de 6 a 12 años.
Jerica Pitts, vocera de Pfizer, dijo que la compañía aún no ha hecho ninguna actualización a su esquema de pruebas o fechas de entrega, las cuales se predijo originalmente que reportarían en septiembre los resultados para niños de 5 a 11 años, seguidos por los resultados de niños de 2 a 5 años poco tiempo después y finalmente los resultados para niños de apenas 6 meses en adelante para octubre o noviembre.
Pfizer diseñó originalmente sus pruebas para incluir a 4.500 niños de 6 meses a 12 años. Dos tercios recibirían la vacuna, y el resto recibiría un placebo. En una reunión del comité consultivo de la Administración de Alimentos y Medicamentos (Food and Drug Administration, FDA por sus siglas en inglés), varios expertos dijeron que ellos esperarían que las pruebas pediátricas fueran más amplias, aunque no hubo consenso en cuanto a un número exacto.
La FDA quiere tener particular cuidado con la posibilidad de que los niños desarrollen miocarditis, o inflamación cardíaca, después de recibir una vacuna contra el coronavirus. Los adolescentes que reciben la vacuna son más propensos a desarrollar miocarditis que los adultos — aunque el riesgo sigue siendo pequeño – y los oficiales quieren aumentar las probabilidades de que las pruebas indiquen si hay un aumento en la incidencia de inflamación cardíaca en los niños.
La miocarditis y la pericarditis, inflamación del corazón y de los tejidos circundantes, rara vez han ocurrido después de una vacunación con ambos tipos de vacunas y es considerada por el Centro para Control y Prevención de Enfermedades (CDC por sus siglas en inglés) como “probablemente” asociada a las inyecciones. Los síntomas más comunes son dolor en el pecho. La CDC dijo en junio que hasta ese momento había habido más de 1.200 casos de inflamación cardíaca de un universo de alrededor de 300 millones de dosis de vacunas ARNm que fueron suministradas en los Estados Unidos en aquel momento y los casos fueron más frecuentes en adultos jóvenes. Los riesgos de contraer Covid-19 son mayores que los poco comunes riesgos de reaccionar adversamente a la vacuna, y las personas por lo general se recuperan, dijo el CDC.
Es probable que la FDA solicite dos meses de datos de seguimiento para el grupo entre 5 y 11 años, al igual que lo hizo para adultos y adolescentes. Para niños menores de 5, la agencia puede requerir cuatro a seis meses de datos de seguimiento, lo que significa que las vacunas difícilmente estarán disponibles para bebés y niños por unos cuantos meses.
La vocera de la FDA, Abigail Capobianco, dijo en un email que aunque la agencia no puede comentar sobre las interacciones específicas con las compañías, “por lo general trabajamos con patrocinantes para asegurarnos de que el número de participantes en las pruebas clínicas sea lo suficientemente grande como para detectar eventos adversos”.
David Benkeser, especialista en estadística que trabaja en las pruebas clínicas del Emory University’s Rollins School of Public Health, dijo que incrementar el número de participantes en las pruebas sería beneficioso para identificar cualquier posible evento adverso.
“En cuanto a las fechas estimadas, definitivamente se van a retrasar”, dijo Benkesser en un email, señalando que el período del retraso dependerá de lo rápido con que se puedan enlistar participantes para las pruebas. Pero después de eso, probablemente tomará unas cuatro o cinco semanas suministrarles inyecciones a los participantes y luego dos semanas más para medir sus sistemas inmunes.
La agencia aún no ha decidido qué se necesitará para el inicio de las pruebas para niños menores de 5 años. Las decisiones seguramente van a depender de si las cifras para niños mayores son claras e indican que no hay ningún efecto adverso, dijo un funcionario federal, quien habló en condición de anonimato por no tener autorización para declarar públicamente.
El oficial también enfatizó que una prioridad urgente para la administración es otorgarle completa aprobación a la vacuna de Pfizer – quizá para finales de este verano.
El individuo dijo que una aprobación completa pudiera significar que unos 25 millones de personas adicionales se terminarán vacunando – 5 millones que pudieron no haber aceptado la vacuna hasta su aprobación final y otros 20 millones de personas adicionales que pudieran estar incluidas dentro de vacunaciones obligatorias en escuelas, universidades y las fuerzas armadas.
Información de las Autoras:
Yasmeen Abutaleb se unió al Washington Post en 2019 como reportera nacional cubriendo temas de salud pública, con foco en el Departamento de Salud y Servicios Humanos, política de salud en Capitol Hill y el derecho a la salud como parte de la política. Previamente cubría temas de salud para Reuters, con foco en la Ley para Seguro Médico Asequible (Affordable Care Act), programas federales de salud y los precios de los medicamentos.
Laurie McGinley cubre temas de salud y medicina para el Washington Post. Se enfoca en la Administración de Alimentos y Medicamento (FDA) así como en investigaciones y curas para el cáncer. Previamente sirvió como la editora del Post para salud, ciencia y ambiente.
Carolyn Johnson es reportera de ciencias. Previamente cubrió los negocios de la salud y la asequibilidad de los seguros médicos para los consumidores.
Lea el artículo original aquí.