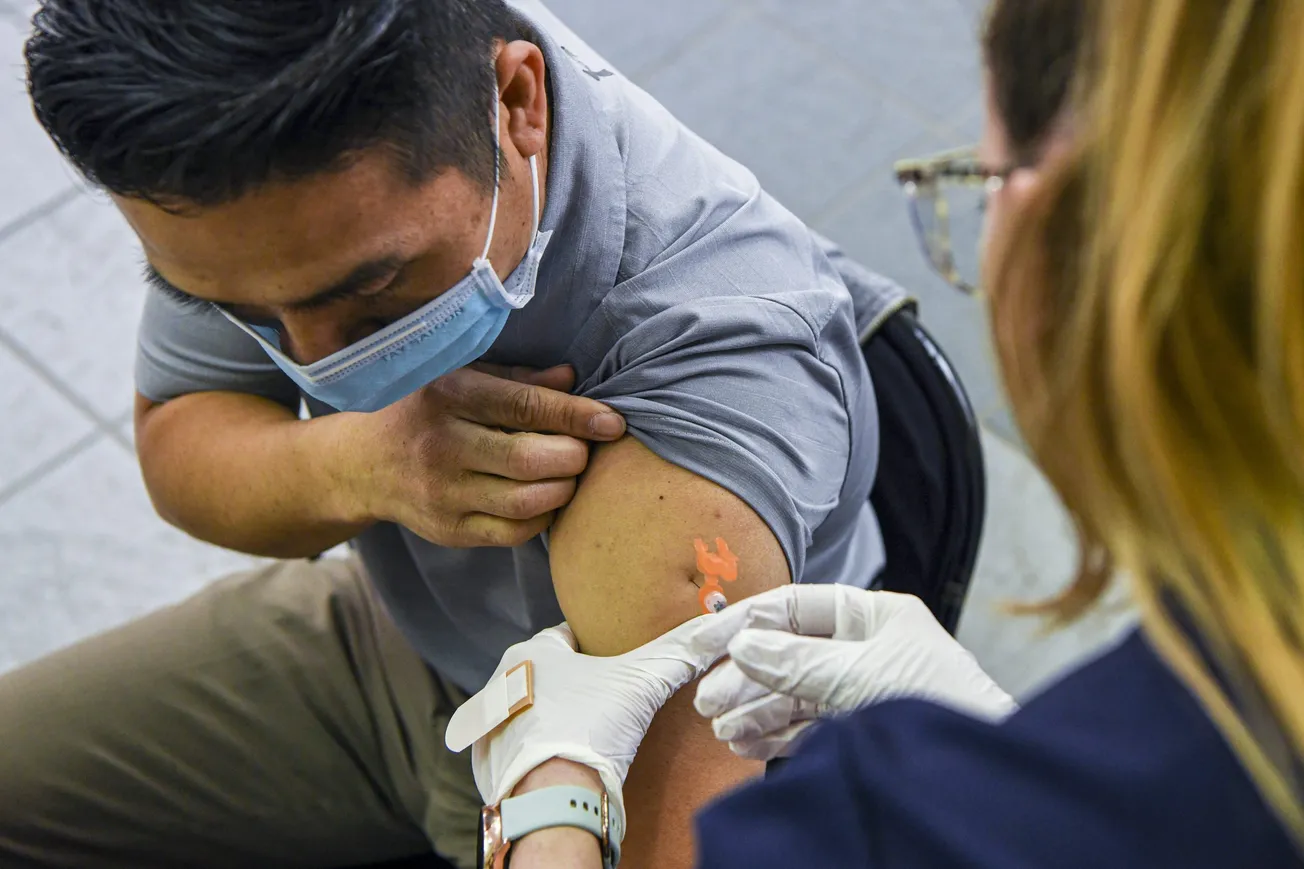
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) aprobó el refuerzo de la vacuna contra el COVID-19 de Novavax para otoño de este año.
La vacuna actualizada de Novavax está diseñada específicamente para combatir las cepas XBB del virus. Este enfoque es similar a las formulaciones modificadas de Moderna y Pfizer, que obtuvieron la aprobación el mes pasado.
Novavax, sin embargo, adopta un enfoque único, que la separa de las vacunas basadas en tecnología de ARNm de Moderna y Pfizer.
Con la aprobación de la FDA, la vacuna de Novavax ofrece una opción sin ARNm basada en proteínas para las personas que buscan protección contra el COVID-19.
John Jacobs, director general de Novavax, declaró que el COVID-19 es actualmente la cuarta causa de muerte en Estados Unidos, por esta razón, es importante la inmunización.
La nueva variante del COVID-19
La variante XBB y sus variaciones siguen siendo las cepas dominantes en todo el país, según los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés).
Esta aprobación de la FDA representa el último obstáculo normativo importante antes de que puedan distribuirse las nuevas vacunas de Novavax.
El doctor Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA, confirmó que la vacuna recién aprobada, cumple los criterios de seguridad, eficacia y calidad de fabricación necesarios para la autorización de uso de emergencia.
Los CDC habían informado previamente a su Comité Asesor sobre Prácticas de Inmunización de que no sería necesario volver a reunirse para ampliar las recomendaciones a fin de incluir a Novavax.
Como resultado, la autorización marca la primera vez que muchos estadounidenses previamente vacunados tendrán la oportunidad de optar por la vacuna Novavax basada en proteínas. La empresa ha promocionado esta opción como una alternativa "tradicional" a Pfizer y Moderna.
Dónde estarán disponibles las vacunas
Novavax informó que tiene millones de dosis de vacuna listas para su envío a Estados Unidos, a la espera de que la FDA apruebe cada lote.
Las dosis estarán disponibles en numerosos lugares, como cadenas nacionales de farmacias, consultorios médicos y a través de programas federales como el Bridge Access y Vaccines for Children.
La aprobación de la vacuna de Novavax llegó más tarde de lo esperado. En un principio, el fabricante de vacunas tenía previsto entrar en el mercado estadounidense en septiembre.
La portavoz de la FDA, Cherie Duvall-Jones, declaró que la aprobación se basaba en la presentación realizada por Novavax, redirigiendo cualquier otra consulta a la empresa, según expone NBC News.
En agosto, Novavax anunció que había iniciado la presentación ante la FDA de sus vacunas. Cabe mencionar que las vacunas sin ARNm como la de Novavax suelen tardar más en producirse, lo que podría explicar el retraso en la aprobación.
La FDA esperó hasta junio para finalizar su selección de la variante a la que iban dirigidas las vacunas actualizadas. Tanto las autoridades sanitarias como los ejecutivos de Novavax coincidieron en que esto podría suponer un reto para las vacunas sin ARNm debido al menor tiempo de respuesta.
Puedes leer:
Beneficiarios de Medicare podrían pagar menos: farmacéuticas negociarán precios de medicamentos