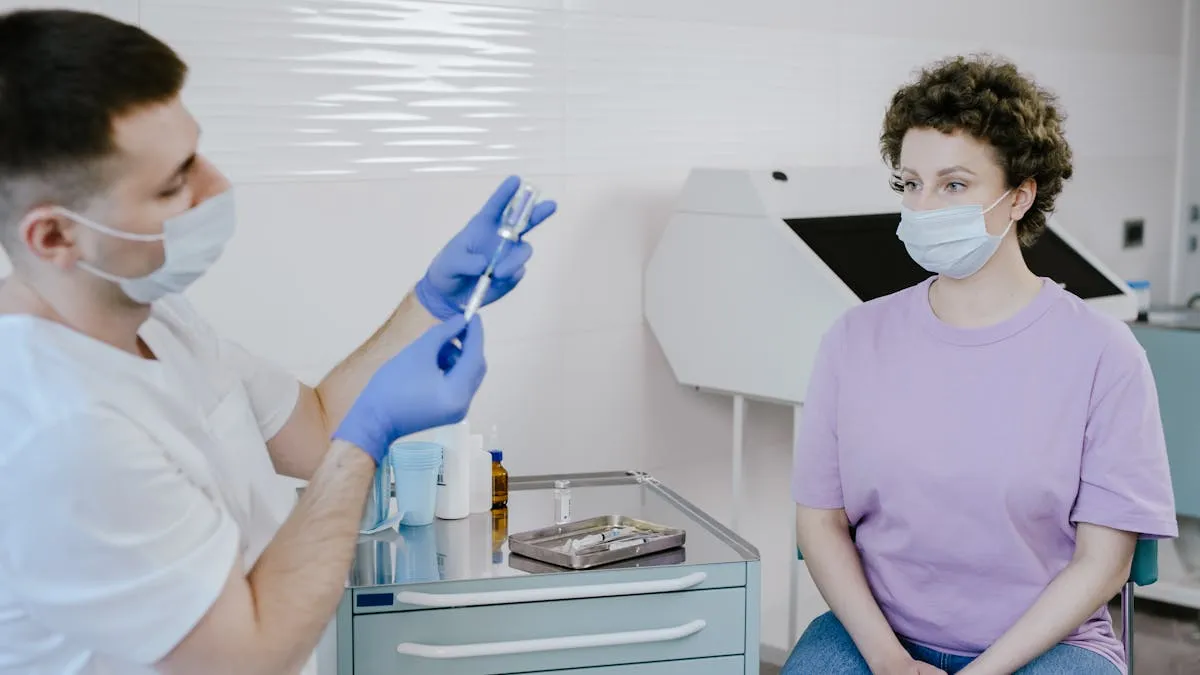
La Administración de Alimentos y Medicamentos (FDA) amplió la autorización del Kisqali, un fármaco inicialmente destinado al cáncer de mama metastásico, para incluir ahora a las pacientes con cáncer de mama en fase inicial.
Novartis, la empresa farmacéutica responsable del Kisqali, anunció este avance crucial, que ofrece una opción de tratamiento vital a decenas de miles de mujeres diagnosticadas de cáncer de mama en fase inicial.
Esta ampliación pretende reducir significativamente la recurrencia de la enfermedad. En un ensayo clínico de fase 3 realizado por Novartis, el Kisqali se mostró muy prometedor.
Redujo el riesgo de recurrencia en un 25% a lo largo de tres años cuando se utilizó junto a tratamientos estándar como la quimioterapia, la cirugía, la radioterapia y la terapia hormonal.
Vandana Abramson, codirectora del Programa de Investigación sobre el Cáncer de Mama del Centro Oncológico Vanderbilt-Ingram de Nashville, destacó a NBC News la importancia de estas ganancias incrementales, explicando: "Si una paciente tenía un riesgo de recidiva del 10%, esto podría reducirlo al 7%."
Anteriormente, Verzenio, otro fármaco de la misma clase, era la única opción aprobada para el cáncer de mama en fase inicial con un alto riesgo de recidiva.
La aprobación de Kisqali
Con la aprobación ampliada de Kisqali, ahora se dirige a un grupo de pacientes más amplio, incluidas aquellas con una enfermedad menos agresiva en el momento del diagnóstico. Teplinsky también señaló que el Kisqali podría ofrecer menos efectos secundarios en comparación con su homólogo.
La autorización incluye a las pacientes con cáncer de mama HER2 negativo y HR positivo en los estadios dos y tres del diagnóstico, lo que indica que el cáncer está localizado en la mama o en los ganglios linfáticos cercanos.
Esta autorización se produce en respuesta al aumento de las tasas de cáncer de mama entre las mujeres más jóvenes.
Entre 2000 y 2019, las tasas de cáncer de mama en mujeres de 20 a 49 años aumentaron un 15,6%, según revela un estudio publicado en JAMA Network Open. Nikki Odum, diagnosticada a los 36 años, compartió su historia diciendo: "Pensé: No estoy preparada para morir, así que ¿qué tengo que hacer?".
Tras un minucioso proceso de tratamiento que incluyó una mastectomía doble, quimioterapia y radioterapia, su médico le sugirió unirse al ensayo clínico Kisqali. "Para mí fue pan comido", recuerda Odum.
El ensayo, dirigido por la Dra. Denise Yardley en el Instituto de Investigación Sarah Cannon de Nashville, requería que las participantes siguieran una terapia hormonal estándar o añadieran Kisqali durante tres años tras el tratamiento principal.
Algunas participantes experimentaron efectos secundarios como recuentos bajos de glóbulos blancos y elevación de las enzimas hepáticas. El Dr. Yardley explicó el enfoque, afirmando: "Si alguien experimentaba un efecto secundario, normalmente reteníamos el fármaco, tratábamos el síntoma y reiniciábamos el tratamiento. Si reaparecía, reduciríamos la dosis".
A pesar de una interrupción temporal del tratamiento debido a una erupción cutánea, Odum valoró positivamente su participación. "Para mí, el Kisqali fue una ventaja. Creo que me ayudó", afirmó. Aunque el ensayo duró tres años, la necesidad de datos a largo plazo para hacer un seguimiento de las recurrencias tardías sigue siendo importante.
El Dr. Abramson señaló el coste sustancial del Kisqali, estimando que los gastos de bolsillo para un tratamiento de tres años oscilarían entre 300.000 y 400.000 dólares.
Sin embargo, con la ampliación de la aprobación, la cobertura de los seguros es más probable, lo que aliviará la carga financiera de los pacientes, pero aumentará los costes del sistema sanitario.