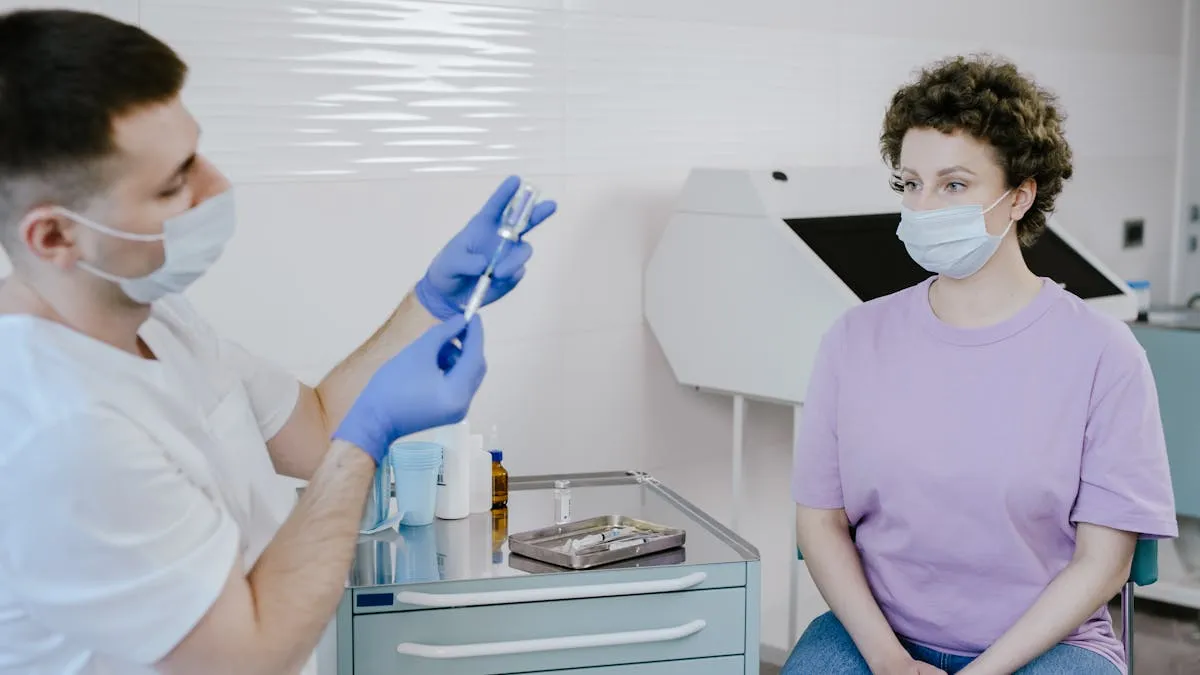
Este lunes, la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) aprobó un nuevo tratamiento contra el Alzheimer. El organismo no había autorizado un medicamento para esta enfermedad desde el 2003.
Por medio de un comunicado, Patrizia Cavazzoni, directora del Centro de Evaluación e Investigación de Medicamentos de la FDA, dijo que se tomó la decisión en medio de una “aprobación acelerada” con el objetivo de que los pacientes de enfermedades graves tengan acceso a medicamentos y terapias sin actualmente presentan “una necesidad insatisfecha” o “una expectativa de beneficio clínico”.
“Al determinar que la solicitud cumplía con los requisitos para la aprobación acelerada, la Agencia concluyó que los beneficios de Aduhelm para los pacientes con enfermedad de Alzheimer superaban los riesgos de la terapia”, explicó Cavazzoni.
Esta decisión se produce en medio del debate entre expertos en Alzheimer y un comité asesor independiente, quienes rechazan la aprobación del medicamento Aducanumab de Biogen. Los expertos aseguran que todavía no hay suficiente evidencia sobre la efectividad del mismo.
Te puede interesar: EEUU y Guatemala trazan líneas de acción para reducir la migración
Sin embargo, la FDA asegura que la demanda de nuevos tratamientos para esta enfermedad es urgente pues alrededor de 6 millones de estadounidenses sufren la patología, además de ser la sexta causa principal de muerte en los Estados Unidos.
El tratamiento, conocido también por la marca Aduhelm, “se considera el primer tratamiento en registrar el progreso en la eliminación de los depósitos de proteínas llamadas placas beta amiloides en el cerebro al inicio de la enfermedad de Alzheimer, lo que ralentiza el deterioro cognitivo”, informó The Hill.
Con esta aprobación, Biogen deberá desarrollar otro ensayo que demuestre el beneficio clínico del medicamento. De no comprobarse, la FDA puede revertir su decisión.
“Creemos que los datos respaldan la aprobación acelerada, al tiempo que responsabilizan a la compañía por realizar un estudio adicional para confirmar los beneficios observados en uno de los ensayos, lo que tenemos la intención de hacer”, dijo Cavazzoni.